章也 1 ,李东阳 1 ,李益民 1 ,罗丰华 1 ,舒畅 2 ,李松 1
(1. 中南大学 粉末冶金国家重点实验室,长沙 410083;2. 中南大学 湘雅二医院血管外科,长沙 410011)
摘 要: 作为生物可降解材料,Fe-Mn 合金具备良好的力学性能和生物相容性,受到广泛关注。本文采用注射成 形制备了Fe-xMn (x=25,30,35,质量分数,下同)合金,研究了烧结时间对 Fe-Mn 合金显微组织、力学性能和体外静态降解性能的影响。研究表明:烧结时间对 Fe-Mn 合金相组成无明显影响,而 Mn 含量影响合金的相组成,Fe-35Mn 合金主要由奥氏体组成。所制备注射成形Fe-Mn合金平均晶粒度约为 10~20μm,表面Mn损失约为5.8%~10.82%。烧结时间为7 h 时,Fe-35Mn 合金力学性能最佳,拉伸断裂强度达到 358 MPa,伸长率为10.83%,30 天静态浸泡降解试验显示,该合金浸泡一天降解速率为1 mm/y,且随腐蚀产物堆积而逐渐降低。
关键词: 注射成形;生物可降解合金; Fe-Mn 合金;力学性能;降解性能
中图分类号: R318.08 文献标志码: A
近年来,可降解金属材料在骨科[1]、颅面植入[2] 和心血管支架[3]等生物医学领域的应用迅速增加,有望代替传统的永久性材料,如:不锈钢、镍钛合金、钴铬合金,解决植入物长存体内引发的各种不良组织反应。目前,镁基[4]、铁基[5]和锌基[3, 6]合金是研究较为广泛的可降解材料。与镁基和锌基合金相比,铁基合金具备更优异的综合力学性能,如高的强度、良好的延展性和成形性,一方面能增加植入体的力学可靠性,另一方面可减少植入金属用量,减缓降解产物对人体带来的负担。但铁及其合金降解速率过低,比如,纯铁在 Hank’s 溶液中降解速率仅为 0.008~0.16mm/y,很长时间难以体内降解。因此,如何有效提高其降解速率是可降解铁合金的研究重点[7]。合金化是解决这一问题的有效途径之一,通过添加 Mn、W、S、Pd等合金元素,可在较宽范围内有效调控降解速率(0.145~25.10 mm/y)[8−9]。其中 Mn是比较合适的添加元素,在人体代谢中,Mn参与氨基酸、蛋白质和碳水化合物的代谢过程,在免疫系统的运行、能量的调节和组织的生长、凝血过程中扮演着重要角色。研究表明,就 Fe-Mn 基合金在体液中的降解而言,Mn的释放量远低于其在血液中的毒性水平,逐渐释放的 Mn 也能被机体合理代谢[10]。与此同时,Mn 的电极电位低于Fe,两者结合形成的 Fe-Mn 无限固溶体具有更高的腐蚀电势[8]。当w(Mn)高于29%时, Fe-Mn 合金形成单一的奥氏体相,可以提高核磁共振兼容性[11]。HERMAWAN等[12]率先报道了Fe-Mn合金作为生物可 降解材料的可行性。研究发现,Fe-35Mn 合金降解速率提升至0.52 mm/y,力学性能与316L不锈钢相当,然而其降解速率仍然远逊于镁合金。
目前报道的可降解 Fe-Mn合金大多使用粉末冶金[13− 14]、铸造[15− 16]、锻造[17]等传统的加工制造工艺获得,而制备植入体等细小精密产品时往往需要配合较多后续机加工工序,不利于产品工业化生产。金属注射成形[18− 19]技术作为新型的精细零部件制备技术,已经成功应用于较多材料体系的制备,有望成为生物植入体等医疗产品及器械的制造技术首选,但目前尚未有注射成形Fe-Mn可降解合金的相关研究报道。本文利用注射成形技术制备Fe-xMn (x=25 、30 、35)合金,研究了烧结时间对合金成分变化、显微组织、力学性能以及静态降解性能的影响,为后续注射成形制备可降解 Fe-Mn 生物结构元件提供理论依据。
1.实验
实验所用预合金Fe-50Mn粉末由湖南恒基粉末有限公司提供,通过添加羰基铁粉可以得到不同 Mn 含量的 Fe-25Mn、Fe-30Mn 和 Fe-35Mn 混合粉末
将上述混合均匀的粉末与多组分粘结剂(60%石蜡+36.5%高密度聚乙烯+3.5%硬脂酸)在密炼机中混炼3h,其中金属粉末装载量(体积分数φ,下同)为 58%。随后经过造粒、注射得到标准德拉伸样生坯,最后通过溶剂脱脂(二氯甲烷、40℃、8 h)和热脱脂(氩气、600℃、1 h)两步脱脂法去除粘结剂。考虑到 Mn 的熔点为1 244℃,参照以往的研究[20−21],将烧结温度设置为1200 ℃,分别烧结4、7 和 10 h,炉内真空度保持在10−1 Pa。
根据 ASTMB962- 13标准,采用阿基米德排水法进行烧结坯密度测试,样品经过线切割,碳化硅砂纸 (180-2000#)逐级打磨,氧化硅热解悬浮液抛光后测试。 锰含量用化学滴定法测试。碳含量和氧含量分别通过CS-600 碳硫分析仪和TCH-600氧碳氢分析仪测得。显微组织通过扫描电子显微镜(SEM, Quanta FEG 250, USA)和电子背散射衍射(EBSD, FEI Helios Nanolab G3 UC, USA)观察。相组成通过X射线衍射仪(XRD,D8 Advance, Japan)进行测定。室温力学拉伸试验在电子万能材料试验机(Model 3369, USA)上进行,拉伸速度2.0 mm/min,拉伸试样标尺距离为50 mm,结果取 三个平行试样的平均值。
体外浸泡实验参照ASTM-G31-72标准 ,在 (37±0.5) ℃恒温培养箱中进行。将 Fe-35Mn 合金切割成 10 mm×10 mm×5 mm 块状样品,各面经过 180~2000#砂纸逐级打磨,用蒸馏水、无水乙醇逐次清洗烘干。样品浸泡在 Hank’s 人工模拟体液中,样品表面积与浸泡溶液体积比为 1 cm2:30 mL。浸泡溶液每两天更换一次,静态浸泡1、3、7 、15 和 30 天后取出,用混合溶液(20 g (CN4)2HC6H5O7+100 mL H2O) 在 80 ℃水浴加热20 min 去除试样表面沉积的腐蚀产物,随后用乙醇超声清洗烘干,根据下式计算腐蚀速率:
CR=8.76×104 W (1)
ATP
式中: W为质量损失,g;A 为腐蚀表面积,cm2;
t 为腐蚀时间,h;ρ 为样品密度,g/cm3。
2 结果与讨论
2.1 杂质和密度
图1(a)为不同烧结时间下Fe-Mn 合金实际碳含量和氧含量。碳含量均低于0.1%,说明粘结剂基本脱除。相同的烧结时间下,碳含量随着Mn含量的增加略有增加,氧含量则相反。在烧结过程中,碳与氧结合,生成CO 或CO2,随着碳含量的增加,氧含量逐渐降低,因此,Fe-35Mn合金氧含量维持在较低的水平。而过高的氧含量会损害合金的力学性能[22]。图1(b)为不同烧结时间下Fe-Mn 合金的致密度。合金的密度随着烧结保温时间的延长逐渐增加,随着Mn 含量的增加先增加后下降,其中Fe-30Mn 合金的密度最大,这可能与Mn原子的扩散速率变化有关。研究表明[23−24] Mn的扩散系数随着Mn含量的增加先增大后减小,较大的扩散系数可提高合金烧结活性,加速晶粒长大,因此合金的气孔和晶界逐渐减少,样品的总体积收缩,密度增加。
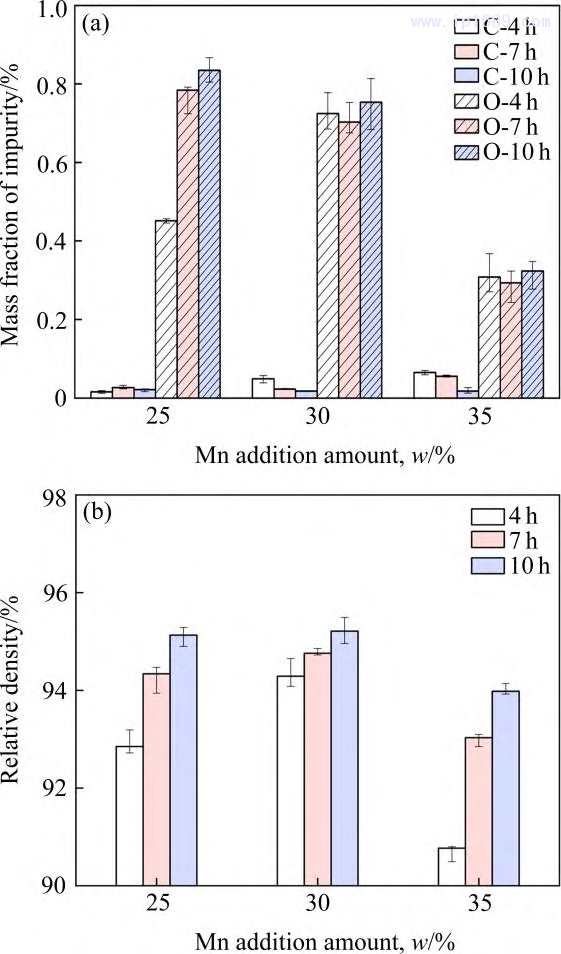
图 1 不同烧结时间 Fe-Mn 合金杂质含量(a)和致密度(b)
2.2 Mn 的损失
锰在真空环境下容易挥发和氧化,很大程度上影响了高质量铁锰合金的制备和利用[25]。温度和压力会影响Mn的挥发程度,Mn 的平衡蒸汽压随温度的变化曲线如图 2 所示。可以看出,1100 ℃以下蒸汽压极低且变化不大,降低烧结温度可以减少挥发,但过低的温 度不利于烧结致密化。 1200℃时Mn的平衡蒸汽压为1.55 Pa,高于1200℃后蒸汽压急剧上升,因此,本研究以 1200℃作为烧结温度。烧结过程中真空度为10−1Pa,炉内压力小于Mn 的平衡蒸汽压,显然不可避免存在 Mn 的挥发[26]。
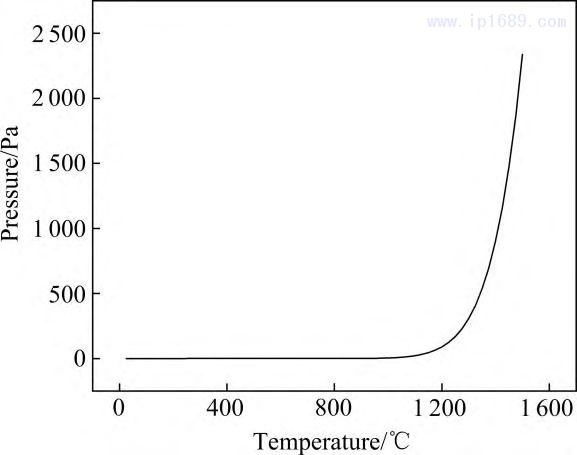
图 2 Mn 的平衡蒸汽压随温度变化曲线
保温时间越长,Mn 的挥发越严重,而Fe的挥发相对于Mn的挥发可以忽略不计[27]。图3为不同烧结时间下Fe-Mn 合金中Mn含量。随着烧结时间的延长,Mn的损失逐渐增加,烧结4 、7和10h 后相比于名义成分Mn 的平均收得率分别为94.2%、92.14%和 89.18%。图4为烧结7 h Fe-30Mn合金的SEM 图像和线扫描图。 Mn的平均质量分数在25%~28%之间,进一步证实Mn的挥发,靠近试样表面 300~400μm 的区域内,Mn 的含量急剧下降。过多Mn 的挥发会改变合金实际成分与相组成,也对真空烧结设备带来污染。因此,必须从两方面来控制Mn的挥发。一方面,需要合理设计烧结温度,调控炉内压力,保证炉内压力大于烧结温度下Mn 的平衡蒸汽压,从而抑制 Mn 的挥发。另一方面,可以根据烧结保温时间与Mn的收得率之间的关系,保证合金Mn含量与烧结保温时间的平衡。
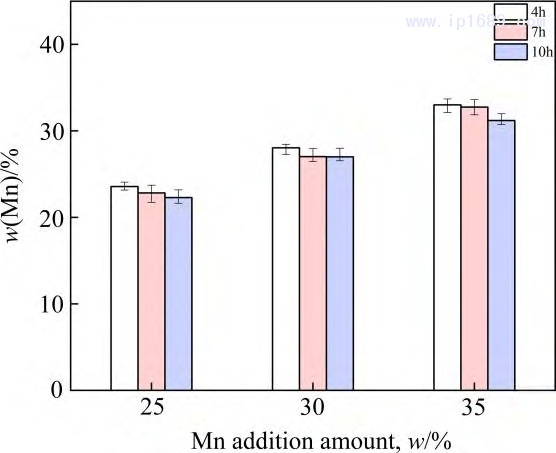
图3 烧结时间和Mn添加量对Fe-Mn合金中Mn的影响
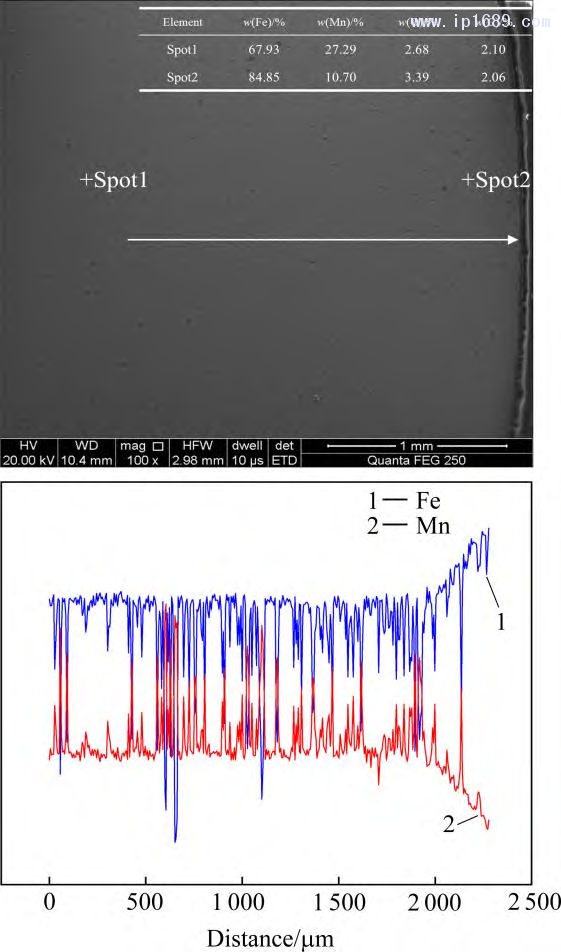
图4 烧结 7 h Fe-30Mn 合金 SEM 图像和线扫描分析
2.3 XRD 与 SEM 分析
图5为不同烧结时间下Fe-Mn合金的XRD图谱。可以看出,烧结时间对 Fe-Mn 合金的相组成无明显影响,而 Mn含量会影响合金相组成和衍射峰的位置。Fe-25Mn 和 Fe-30Mn 合金主要由奥氏体、铁素体和马氏体相组成,但随着Mn含量的增加,奥氏体含量相对增加, 铁素体和马氏体含量减少。其中,Fe-35Mn 合金主要由奥氏体组成,少量-Fe 相的存在可能与局部成分不均匀有关[20]。此外,随着Mn含量的增加,应奥氏体的衍射峰向左偏移,这是由于Mn在铁基体 中的固溶量增加,奥氏体晶格常数增大所致。由于Fe和Mn都易氧化,因此在图中均存在对应氧化物的衍射峰,并且随着Mn含量的增加,氧含量逐渐降低,氧化物衍射峰逐渐减弱。
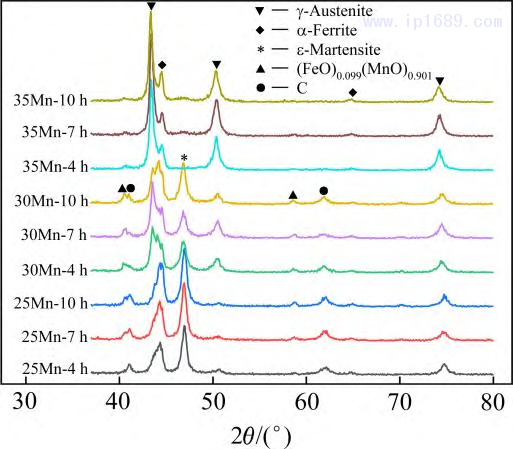
图 5 不同烧结时间 Fe-Mn 合金的 XRD 图谱
图6为烧结7 h Fe-Mn 合金的SEM 图像和能谱分析数据。通过EDS能谱分析可以看出,相比于名义成分,基体的锰含量有一定的损失。基体中弥散分布着一定量的杂质相,Fe-25Mn 和 Fe-30Mn 合金的杂质相大多为锰的氧化物,而Fe-35Mn 合金的杂质相主要以铁的氧化物为主,并且随着Mn 含量的增加,氧化物逐渐减少,这与XRD结果相一致。
2.4 晶粒尺寸分析
图7为不同烧结时间下Fe-Mn合金的晶粒分布图,可以明显看到,所有合金的晶粒尺寸较为均匀,且随着烧结保温时间的延长而逐渐增大。图8为不同 烧结时间下Fe-Mn合金的平均晶粒尺寸,合金晶粒尺寸随 Mn 含量的增加先增加后下降,Fe-30Mn 合金的晶粒尺寸最大,这与Mn的扩散系数变化规律一致。
Mn 含量相同的情况下, 随着烧结保温时间的延长, 晶粒逐渐长大。

图 7 不同烧结时间 Fe-Mn 合金的晶粒分布图
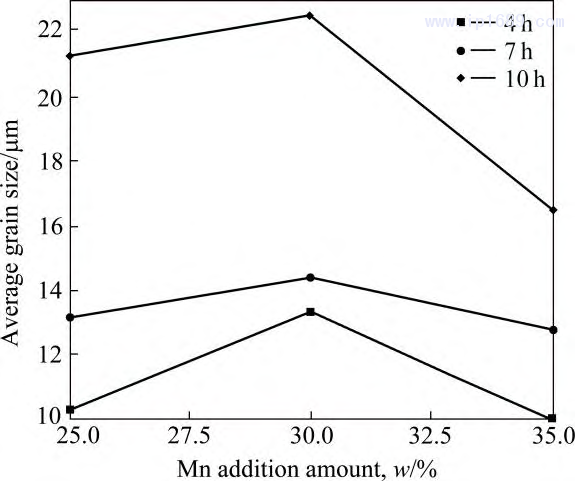
图 8 不同烧结时间 Fe-Mn 合金平均晶粒尺寸
2.5 室温拉伸力学性能
图9为不同烧结时间Fe-M下合金的室温拉伸力学性能。其中抗拉强度如图 9(a)所示,三种 Fe-Mn 合金均在烧结7h后获得最高抗拉强度。如前所述,Fe-25Mn、Fe-30Mn、Fe-35Mn 随着烧结时间由4h延长至10h,致密度分别由92.85%、94.29%、90.77%提升至95.13%、95.21%、93.98%,孔隙的减少虽有利于抗拉强度的提高。但平均晶粒度的大幅提高(图8) ,导致细晶强化机制减弱,从而使合金的抗拉强度降低。
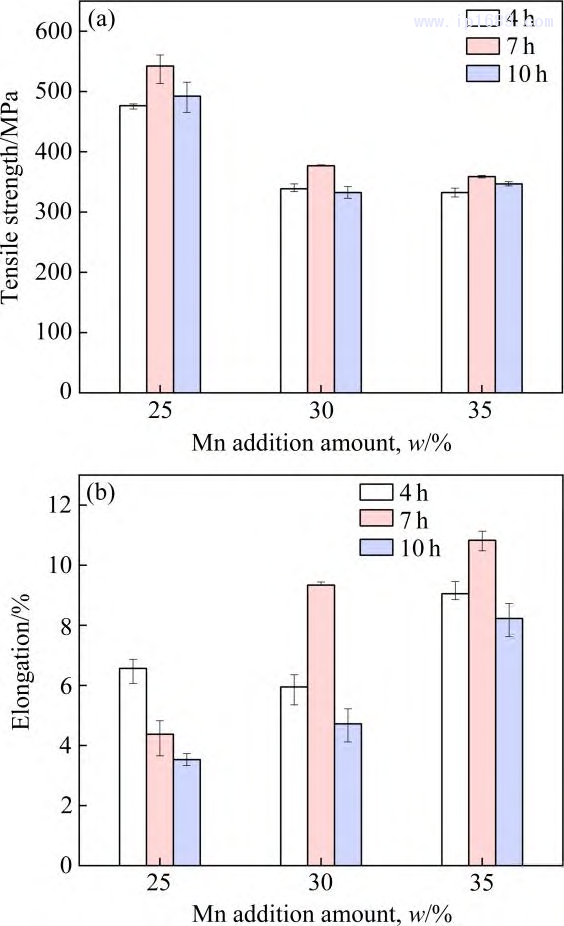
相同的烧结时间,随着Mn含量的增加,合金的抗拉强度逐渐下降。
研究发现Fe-Mn 合金中Mn含量的提高会降低弹 性模量, 提高塑性[28]。如图9(b)所示, 合金伸长率整体上随Mn含量增加而逐渐增加。对三种 Fe-Mn 合金而言,当烧结时间为7 h 时,Fe-30Mn 和Fe-35Mn合金不仅拥有最高的抗拉强度,其伸长率也最高,而对于Fe-25Mn 合金,烧结7 h的伸长率相较与4 h要差,可能与其杂质氧含量的成倍增长有关,过高的氧含量 会导致合金的脆性增加[29]。
图 10 为不同烧结时间 Fe-Mn 合金室温拉伸断口形貌图。相同的烧结时间,随Mn含量的增加,合金 的韧窝数量增多,韧性更好。Fe-35Mn合金断口均表现出大而多的韧窝(图 10(g)~(i))。Mn 含量相同时,随着烧结时间的延长,三种 Fe-Mn 合金的塑性先升高后降低,其中,Fe-25Mn 合金烧结10h断口表现为韧−脆过渡断裂特征,可以清楚地看到准解离断裂形貌,并且伴随着裂纹的产生(图10(c))。烧结7 h的 Fe-35Mn合金显示出大量的塑性脊和较大的韧窝(图10(h)),塑性相对最好,与图9(b)一致。
本研究通过注射成形制备的Fe-Mn合金在抗拉强度方面满足了临床上对可降解血管支架材料的要求,抗拉强度大于300 MPa,但伸长率低于15%,与同成分通过熔炼法制备的Fe-Mn 降解合金存在差距[30],主要原因在于不能完全消除的孔隙和较高的碳氧杂质。金属注射成形可降解 Fe-Mn 合金的开发,有利于实现复杂微细零部件、植入体的精确快速制备,但是需要对成分设计、原材料制备、杂质控制等方面进一步开展研究,提高产品综合力学性能。
金进行静态浸泡降解性能研究。图11 为烧结7hFe-35Mn 合金的降解速率随浸泡时间的变化。可以看出,随着浸泡时间的延长,合金的降解速率逐渐下降,与其它静态浸泡测试实验现象相似,归因于表层腐蚀 产物的堆积[14, 31]。图12为降解15天合金表面微观组织形貌图,点扫描分析显示表面覆盖物以氧化物和磷酸盐为主。铁的降解速率为0.008~0.036 mm/y,其降解速率与永久支架无异[7]。本研究中Fe-35Mn 合金浸泡一天时降解速率可以达到1 mm/y,高于纯铁和大部分铁基合金。本研究制备的Fe-Mn进一步拉近了铁合金与镁合金的降解周期,有望在12~24月实现完全降解。
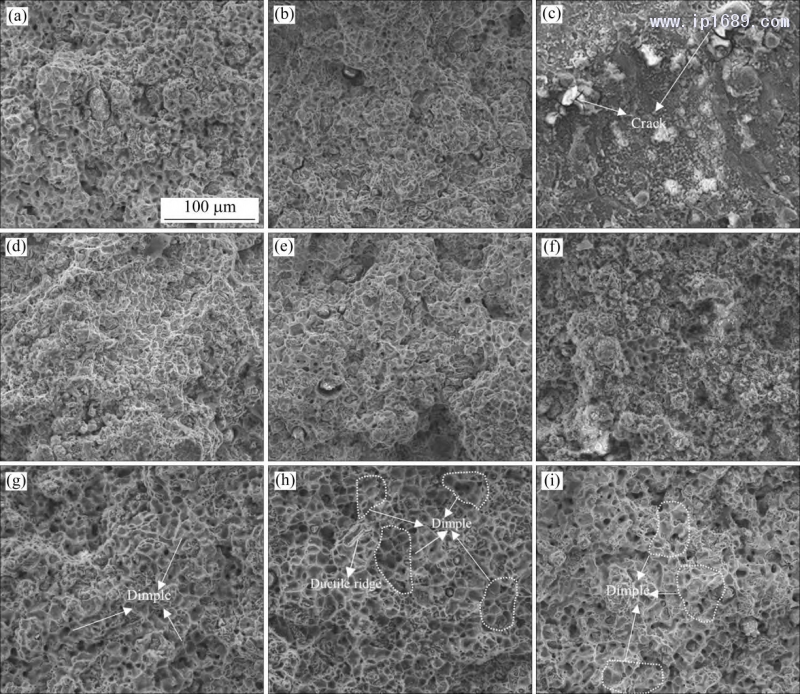
图 10 不同烧结时间 Fe-Mn 合金室温拉伸断口形貌
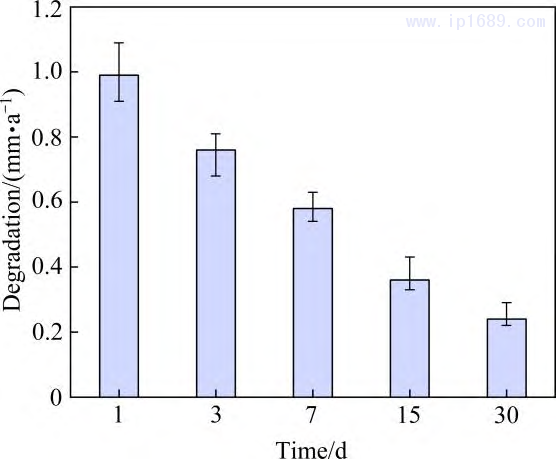
图11 Fe-35Mn-7h合金的降解速率随浸泡时间变化 图 12 Fe-35Mn-7h 合金浸泡 15天表面组织形貌图
除成份外,降解速率受晶粒尺寸、杂质含量、孔隙率以及降解环境影响较大。研究表明[32]晶粒越细小均匀,相对晶界密度越高, 晶粒内部与晶界之间所形成的微电偶腐蚀能增加降解速率。杂质含量偏高,带来的杂质相也有类似的效应[33]。孔隙率也是影响合金降解速率的重要因素,额外的孔隙会增加合金在腐蚀环境中的暴露面积,提高降解速率[31]。研究报道[14] 的多孔可降解合金,降解速率达2~8 mm/y。当前铁基生物可降解合金所面临的最大难题是降解速率过慢,不能在治疗周期内及时代谢移除,因此如何在保证合金力学可靠性的同时提高其降解速率,使其在体内完全降解的速度与组织修复的速度相匹配仍然需要进一步研究。
3 结论
本文设计制备了注射成形 Fe-xMn (x=25、30、35) 合金,研究了烧结时间对 Fe-Mn 合金中 Mn 的挥发损失以及显微组织、力学性能、体外静态降解性能的影响,主要结论如下:
1) 烧结时间对Fe-Mn合金的相组成无明显影响,而Mn含量会影响合金的相组成,其中 Fe-35Mn合金主要由奥氏体组成;烧结过程中存在碳与氧的反应和Mn的挥发,Fe-35Mn合金氧含量维持在较低水平,Mn的挥发在试样表面300~400μm区域内尤为明显;Fe-Mn合金的致密度为90.8%~95.1%,平均晶粒度约为 10~20μm,两者随着烧结保温时间延长而增加。
2) Fe-Mn合金抗拉强度随着烧结保温时间的延长 先增加后降低,伸长率随Mn含量增加而逐渐增加,烧结时间为7h的Fe-35Mn 合金抗拉强度达358 MPa,伸长率达 10.83%。
3) 烧结7hFe-35Mn 合金降解速率达到1 mm/y,高于大多数其它方法制备的同类合金;随着浸泡时间的延长,表层腐蚀产物的堆积会使合金的降解速率逐渐下降。
参考文献
[1] LI Zijian, GU Xunan, LOU Siquan, et al. The development of binary Mg-Ca alloys for use as biodegradable materials within bone[J]. Biomaterials, 2008, 29(10): 1329−1344.
[2] SARAHE, HENDERSONA, KONSTANTIONSVB, et al. Magnesium alloys as a biomaterial for degradable craniofacial screws[J]. Acta Biomaterialia, 2014, 10(5): 2323−2332.
[3] YANG Hongtao, WANG Cong, LIU Chaoqiang, et al. Evolutionof the degradation mechanism of pure zinc stent in the one-year study of rabbit abdominal aorta model[J]. Biomaterials, 2017,145: 92−105.
[4] SCHRANZ D, ZARTNER P, MICHEL-BEHNKE I, et al. Bioabsorbable metal stents for percutaneous treatment of critical recoarctation of the aorta in a newborn[J]. Catheterization and Cardiovascular Interventions, 2010, 67(5): 671−673.
[5] 徐文利, 吴竞尧, 谭丽丽, 等. 可降解铁基心血管支架材料的研究进展[J]. 材料导报, 2012, 26(1): 75−78.
[6]GONG Haibo, WANG Kun, STRICH R, et al. In vitro biodegradation behavior, mechanical properties, and cytotoxicity of biodegradable Zn-Mg alloy[J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2015, 103(8):1632−1640.
[7] PEUSTER M, WOHLSEIN P, EHLERDING M, et al. A novel approach to temporary stenting: degradable cardiovascular stents produced from corrodible metal-results 6- 18 months after implantation into New Zealand white rabbits[J]. Heart, 2001,86(5): 563−569.
[8] SCHINHAMMER M, HANZI A C, LOFFERR J F, et al. Design strategy for biodegradable Fe-based alloys for medical applications [J]. Acta Biomaterialia, 2010, 6(5): 1705−1713.
[9] LIU B, ZHENG Y F. Effects of alloying elements (Mn, Co, Al, W, Sn, B, C and S) on biodegradability and in vitro biocompatibility of pure iron [J]. Acta Biomaterialia, 2011, 7(3):1407−1420.
[10] HERMAWAN H, PURNAMA A, DUBE D, et al. Fe-Mn alloys for metallic biodegradable stents: degradation and cell viability studies[J]. Acta Biomaterialia, 2010, 6(5): 1852−1860.
[11]RABINKIN A. On magnetic contributions to γ→ε phase transformations in Fe-Mn alloys[J]. Calphad-Computer Coupling of Phase Diagrams & Thermochemistry, 1979, 3(2): 77−84.
[12] HERMAWAN H, ALAMDARI H, MANTOVANI D, et al. Iron-manganese: New class of metallic degradable biomaterials prepared by powder metallurgy[J]. Powder metallurgy, 2008, 51(1): 38−45.
[13] HERMAWAN H, PURNAMA A, DUBE D, et al. Fe-Mn alloys for metallic biodegradable stents: degradation and cell viability studies[J]. Acta Biomaterialia, 2010, 6(5): 1852− 1860.
[14] ZHANG Qian, CAO Peng. Degradable porous Fe-35wt.% Mn produced via powder sintering from NH4HCO3 porogen[J]. Materials Chemistry Physics, 2015, 163: 394−401.
[15] DRYNDA A, HASSEL T, BACH F W, et al. In vitro and in vivo corrosion properties of new iron-manganese alloys designed forcrdiovascular applications[J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2015, 103(3): 649−660.
[16] LIU B, ZHENG Y F, RUAN Liquan. In vitro investigation of Fe30Mn6Si shape memory alloy as potential biodegradable metallic material[J]. Materials Letters, 2011, 65(3): 540−543.
[17]CAPEK J, KUbaseK J, DALIBOR V, et al. Microstructural, mechanical, corrosion and cytotoxicity characterization of the hot forged FeMn30(wt.%) alloy[J]. Materials Science & Engineering C, 2016, 58: 900−908.
[18] 舒畅, 蔡文武, 何昊, 等. 粉末冶金注射成型技术制备的新型血管内支架的动物应用研究[J ].中国普通外科杂, 2017, 26(2): 205−212.
[19] MARIOT P, LEEFLANG M A, SCHAEFFER L, et al. An investigation on the properties of injection-molded pure iron potentially for biodegradable stent application[J]. Powder Technology, 2016, 294: 226−235.
[20] HERMAWAN H, DUBE D, MANTOVANI D. Development of degradable Fe-35Mn alloy for biomedical application[J].Advanced Materials Research, 2007, 15/17: 107−112.
[21] HERMAWAN H, DUBE D, MANTOVANI D. Degradable metallic biomaterials: design and development of Fe-Mn alloys for stents[J]. Journal of Biomedical Materials Research Part A,2009, 93(1): 1−11.
[22] 曲选辉, 陈晓玮, 章林, 等. 一种低氧含量的母合金法制备MIM418 合金的方法: 中国, 201611100809.7[p]. 2018−03−13.
[23] 李梦珊, 范景莲, 刘涛, 等. Mn 含量对 Cu-Mn 合金结构与性能的影响[J]. 粉末冶金材料科学与工程, 2016, 21(4): 541−545.
[24] THIBON I, GUILLOU A, GLORIANT T. Interdiffusion in the FCC phase of Cu-Mn binary alloys[J]. Journal of Phase Equilibria & Diffusion, 2012, 33(4): 303−309.
[25]孔令种, 邓志银, 朱苗勇. 中高锰钢在真空精炼过程中的气化行为[J]. 特殊钢, 2018, 39(4): 17−19.
[26] 侯少良. 真空感应熔炼中锰的挥发与控制[J]. 上海金属, 1992,14(2): 60−61.
[27] 王信才. 功能材料 Fe-Mn 合金试制工艺研究[J]. 特钢技术,2010, 16(1): 21−23.
[28] 李冬冬, 钱立和, 刘帅, 等. Mn 含量对 Fe-Mn-C 孪生诱发塑性钢 拉伸变形行为 的 影 响[J]. 金属学报 , 2018, 54(12):1777−1784.
[29] KURAMOTO S, FURUTA T, HWANG J H, et al. Plastic deformation in a multifunctional Ti-Nb-Ta-Zr-O alloy[J]. metallurgical & Materials Transactions A, 2006, 37(3): 657−662.
[30] BOWEN P K, SHEARIER E R, ZHAO S, et al. Biodegradable metals for cardiovascular stents: From clinical concerns to recent Zn‐alloys[J]. Advanced Healthcare Materials, 2016, 5(10):1121−1140.
[31] 李涵, 王烨欣, 崔振山, 等. 喷射成形制备 Fe-35Mn合金的体外降解行为及生物相容性[J]. 腐蚀科学与防护技术, 2018,30(3): 244−250.
[32] 陈连喜. 含锶生物医用镁合金的性能及其应力腐蚀行为研究[D]. 广州: 暨南大学, 2017: 1−129.
[33] 高家诚, 伍沙, 乔丽英, 等. 镁及镁合金在仿生体液中的腐蚀降解行为[J]. 中国组织工程研究与临床康复, 2007, 18(2): 3584−3586.













 玻纤含量对长玻纤...
玻纤含量对长玻纤... 钙钛矿薄膜的均匀...
钙钛矿薄膜的均匀... 用于光伏板静电除...
用于光伏板静电除... 聚砜医疗干粉吸入...
聚砜医疗干粉吸入...














